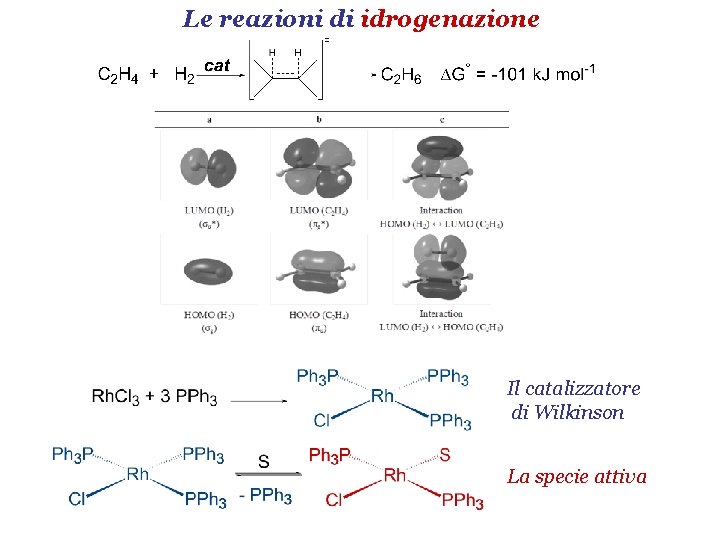
Catalizzatore di Wilkinson è la denominazione comune del composto chimico clorotris(trifenilfosfina)rodio(I), composto di coordinazione con formula RhCl(PPh3)3 (Ph = fenile). Deve il suo nome al chimico organometallico Sir Geoffrey Wilkinson, premio Nobel nel 1973, che rese popolare il suo utilizzo. È stato il primo catalizzatore in grado di idrogenare alcheni e alchini in soluzione omogenea a temperatura e pressione ambiente.
Struttura e proprietà
RhCl(PPh3)3 è un complesso a 16 elettroni con struttura planare quadrata. In condizioni normali è un solido cristallino rosso-violetto. Si prepara facendo reagire tricloruro di rodio idrato con trifenilfosfina in eccesso, in etanolo a riflusso. La trifenilfosfina funge anche da riducente e forma il corrispondente ossido di trifenilfosfina:
- RhCl3(H2O)3 4PPh3 → RhCl(PPh3)3 O=PPh3 2HCl 2H2O
Applicazioni catalitiche
Il catalizzatore di Wilkinson catalizza l'idrogenazione di alcheni. Il meccanismo è illustrato nello schema seguente, e prevede i seguenti processi:
- dissociazione iniziale di un legante PPh3 e coordinazione di una molecola di solvente per formare specie a 16 elettroni
- coordinazione di H2 con una reazione di addizione ossidativa
- complessazione dell'alchene in modalità π
- trasferimento intramolecolare dell'idruro (inserzione dell'olefina)
- eliminazione riduttiva dell'alcano prodotto.
Il catalizzatore di Wilkinson riesce a funzionare in modo ideale in questo ciclo perché può cambiare agevolmente il suo numero di coordinazione, e possiede due stati di ossidazione che differiscono di due unità ( 1 e 3), entrambi facilmente accessibili.
Tra le altre applicazioni del catalizzatore di Wilkinson ci sono l'idroborazione catalitica di alcheni e la riduzione selettiva di composti carbonilici α, β-insaturi assieme al trietilsilano. Quando i leganti trifenilfosfina sono sostituiti da fosfine chirali (ad esempio, chiraphos, DIPAMP, DIOP) il catalizzatore diventa chirale, e converte alcheni prochirali in alcheni enantiomericamente arricchiti nel processo chiamato idrogenazione asimmetrica.
Altre reazioni di RhCl(PPh3)3
RhCl(PPh3)3 reagisce con CO per formare il complesso trans-Rh(CO)Cl(PPh3)2, strutturalmente analogo al complesso di Vaska, ma molto meno reattivo. Lo stesso complesso si forma per decarbonilazione di aldeidi:
- RhCl(PPh3)3 RCHO → Rh(CO)Cl(PPh3)2 RH PPh3
Lasciato sotto agitazione in soluzione di benzene, RhCl(PPh3)3 si converte nel dimero poco solubile di colore rosso Rh2Cl2(PPh3)4. Questa conversione è un'ulteriore dimostrazione della labilità del leganti trifenilfosfina.
Sicurezza
RhCl(PPh3)3 va maneggiato con le normali precauzioni dovute con i composti chimici, ma non è considerato pericoloso. Non è classificato come cancerogeno.
Note
Voci correlate
- Regola dei 18 elettroni
Altri progetti
- Wikimedia Commons contiene immagini o altri file su Catalizzatore di Wilkinson
Collegamenti esterni
- (EN) Wilkinson’s catalyst, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.